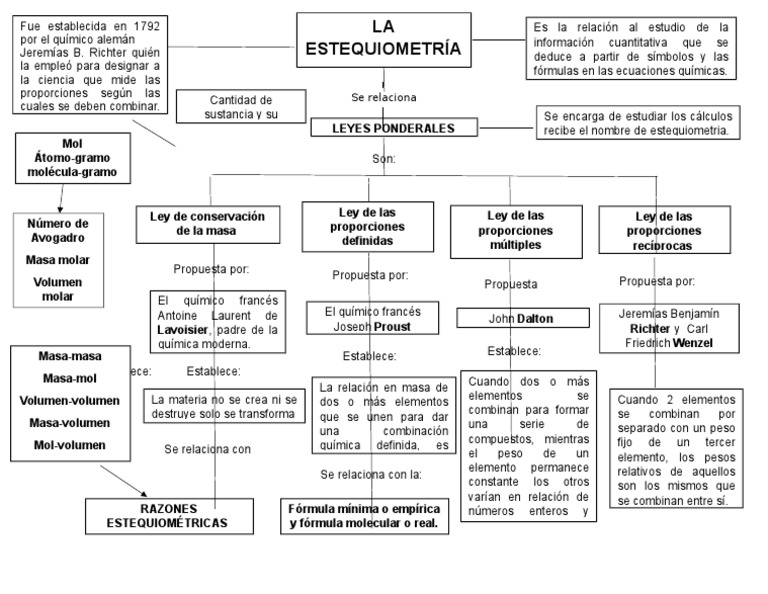
En toda reacción química o física se conserva la masa, es decir, la masa total de los reactivos es igual a la masa total de los productos.La ley de conservación de la masa, enunciada por Lavoisier en 1789, es una de las leyes fundamentales en todas las ciencias naturales.En esta ley se asume la conservación de la identidad de los elementos químicos, que resulta indispensable en el.. Antes de comenzar a describir las leyes estequiométricas, repasemos un poco el concepto de estequiometria. La estequiometria es la sección de la química que estudia las relaciones cuantitativas entre los reactivos y los productos, en una reacción. Según la definición dada por Richter en el año 1792, la estequiometria es la ciencia que.

Estequiometría mapa conceptual ¡Guía paso a paso!

Estequiometría de las reacciones químicas. Nivel básico. YouTube
Leyes De La Estequiometria Tados
Química Estequiometría Ciencia Fácil Academy
Estequiometria en procesos de combustión 2º parte

Leyes De La Estequiometria Tados
Clasificacion De Las Reacciones Quimicas Estequiometria Reacciones Images
Estequiometria
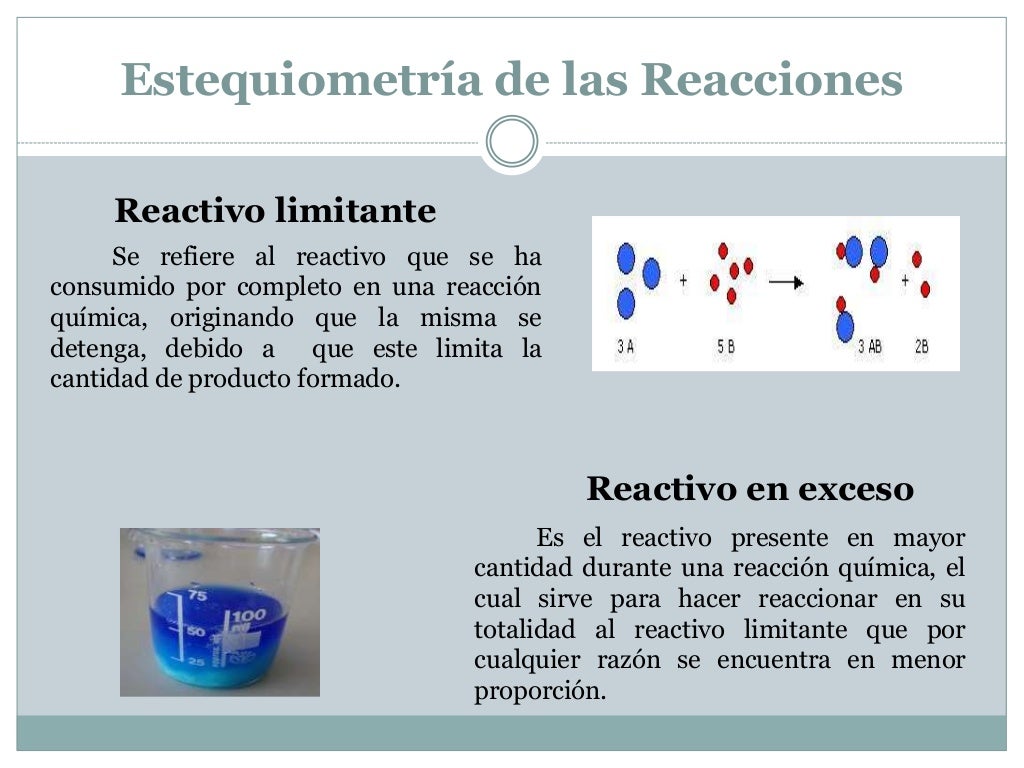
Estequiometría de las reacciones

Estequiometría de reacción Ciencias quimica, Enseñanza de química y Ciencia de escuela secundaria

Leyes Estequiométricas para Cuarto Grado de Secundaria ≫ Materiales

Leyes de la estequiometria Pregunta 1 Leyes de la estequiometria Las leyes de estequiometría

ESTEQUIOMETRÍA en ECUACIONES QUÍMICAS MUY FÁCIL PASO a PASO👍 QUÍMICA YouTube
Unidad 4.1 Leyes ponderales y Estequiometría

Estequiometría, ejercicio empleando la ley de los gases ideales YouTube

Cap 8 Reacciones Quimicas Y Estequiometria Estequiometria Procesos Images

Estequiometría
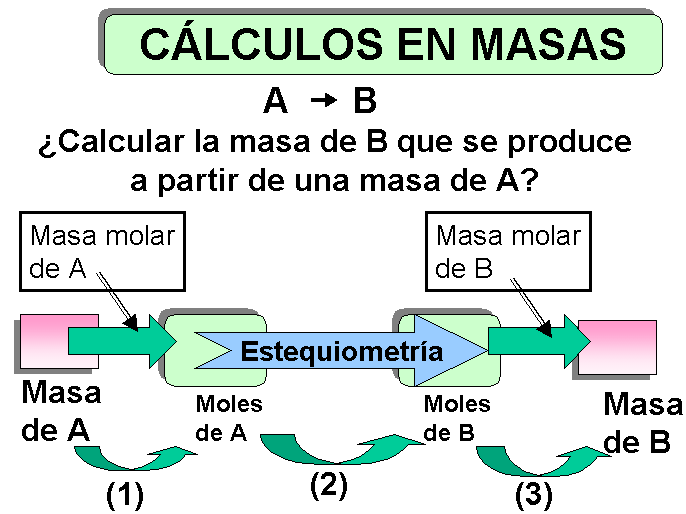
Ciencias Experimentales ESTEQUIOMETRÍA

Estequiometría básica YouTube

Leyes Volumétricas de la Estequiometría para Tercer Grado de Secundaria
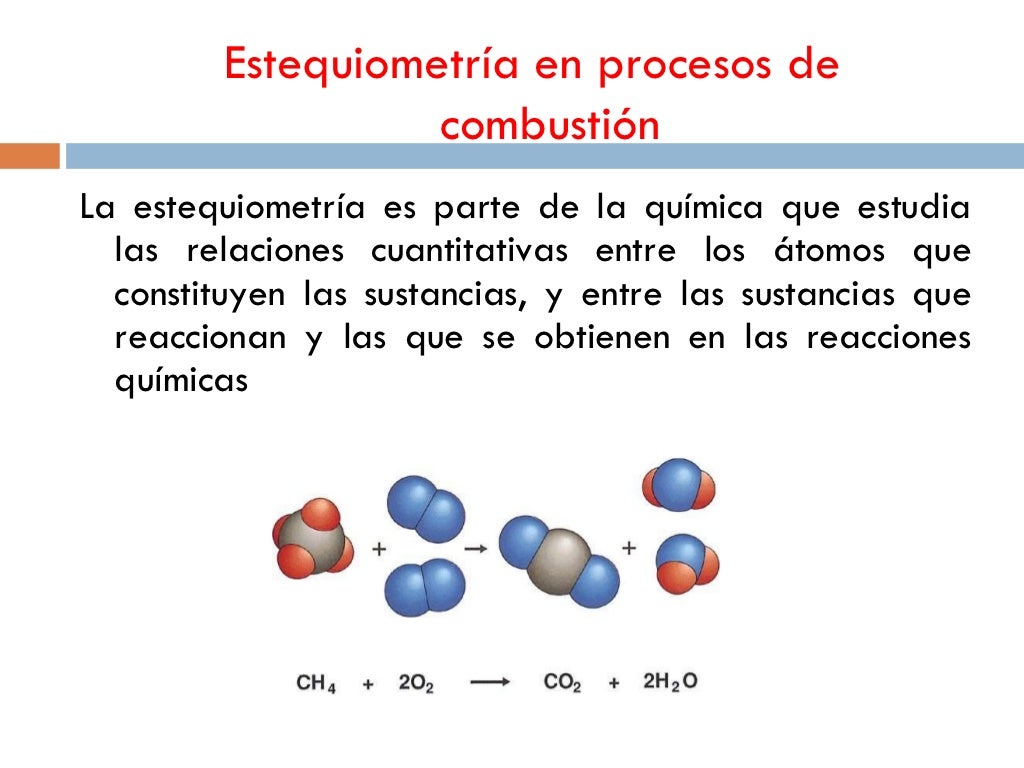
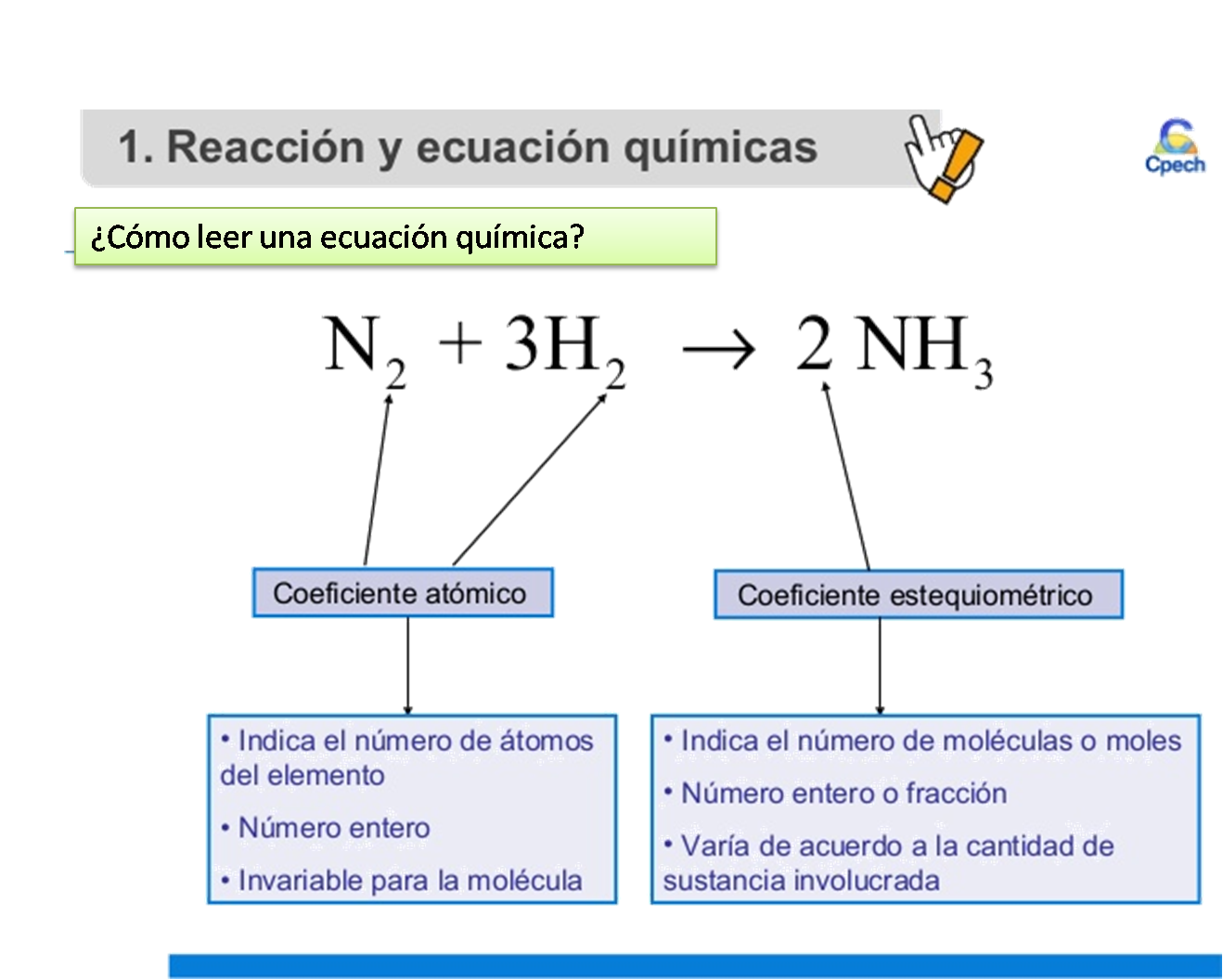
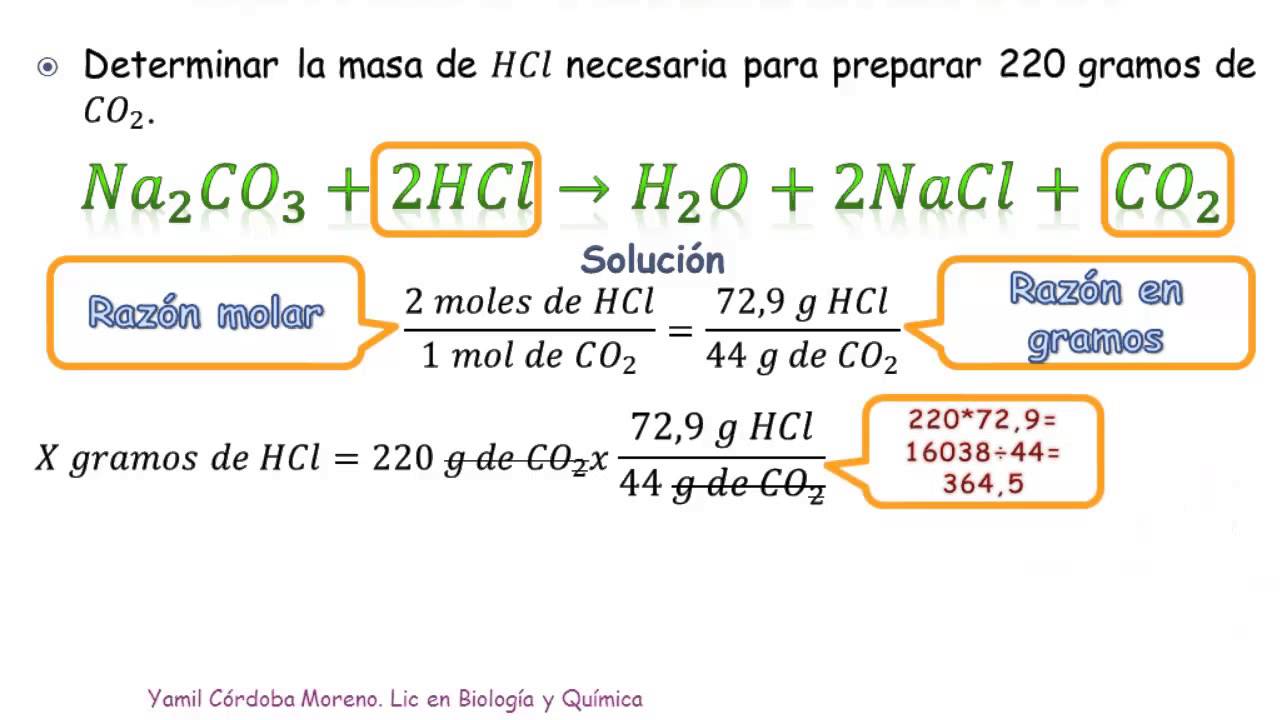
Principio de la estequiometría. Una reacción química se produce cuando hay una modificación en la identidad química de las sustancias intervinientes; esto significa que no es posible identificar a las mismas sustancias antes y después de producirse la reacción química, los reactivos se consumen para dar lugar a los productos.. A escala microscópica una reacción química se produce.. Para convertir de la masa de galio al volumen de H 2(g), necesitamos hacer algo como esto: Las dos primeras conversiones son: 8.88gGa × 1molGa 69.723gGa × 3molH2 2molGa = 0.191molH2. Finalmente, podemos usar la ley de los gases ideales: VH2 = (nRT P)H2 = 0.191mol × 0.08206Latmmol − 1K − 1 × 300K 0.951atm = 4.94L.